新闻中心
电话:【各区域联系方式点击 联系我们 】
400-862-0778
邮箱:dukon@dukon.cn
地址:渡康销售中心:石家庄高新区裕华东路455号润江总部国际大厦4层
渡康研发生产中心:石家庄高新区裕华东路455号润江总部国际11号楼4层5层6层

非侵入性脑刺激技术在缺血性脑卒中康复中的应用与进展
发布时间:
2025-08-01 16:05
缺血性脑卒中是导致死亡和残疾的主要原因之一。全球每年新增卒中病例超过 1220 万,预计到 2047 年,欧洲联盟中卒中患者人数将增加 27%。目前常用的神经康复方法存在诸多局限,如耗时长、对患者依从性要求高,且可能受卒中后神经精神并发症影响。因此,非侵入性脑刺激(NIBS)技术,如经颅磁刺激(TMS)和经颅直流电刺激(tDCS)作为一种新型、安全有效的技术,成为卒中康复领域的研究热点。
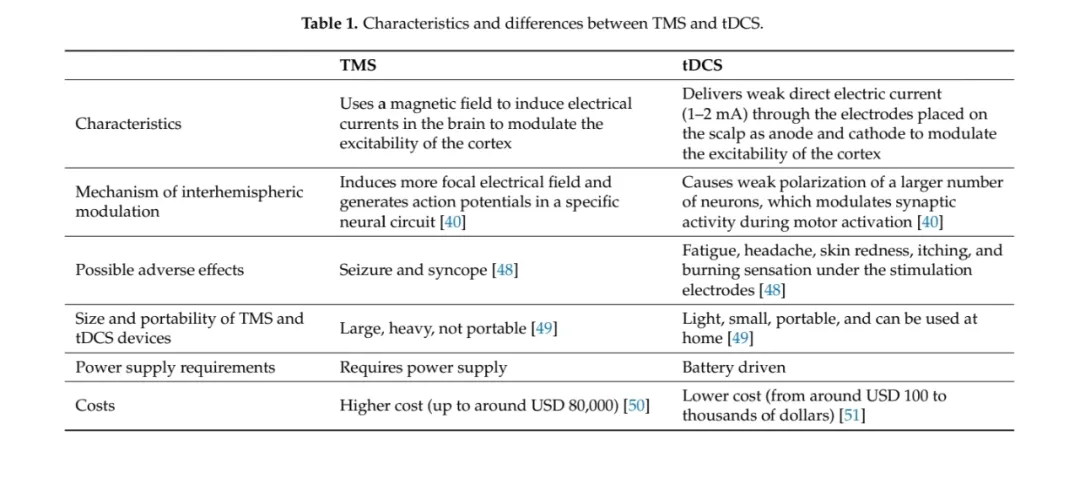
TMS 和 tDCS 的特点和区别
TMS经颅磁刺激
利用磁场在大脑中诱导电流,使神经元去极化并触发动作电位。包括重复经颅磁刺激(rTMS)和θ爆发刺激(TBS)等多种模式。低频 rTMS(0 - 2Hz)抑制皮层兴奋性,高频 rTMS(>5Hz)则增加皮层兴奋性,能改善小鼠 peri - 基底核皮质的谷氨酸能突触传递,促进卒中后运动功能恢复,还可增加小鼠前额叶和初级运动皮质的树突复杂性,诱导神经回路的皮层内重组,改变皮层连接。TBS 通过短时间应用三个高频(50Hz)脉冲模拟内源性θ节律,诱导 LTP 和 LTD 改变,具有长期的突触可塑性效应。
tDCS经颅直流电
通过放置在头皮上的阳极和阴极电极传递弱直流电(1 - 2mA),改变神经元的静息膜电位,从而改变放电概率。阳极 tDCS 增加皮层兴奋性,阴极 tDCS 则降低皮层兴奋性。卒中会导致患侧皮层兴奋性降低,而健侧皮层代偿性增加,进而增加半球间胼胝体抑制,抑制病灶半球活动。不同类型的 tDCS 和不同频率的 TMS 可能对缺血皮层产生兴奋性或抑制性影响。在小鼠模型中,阴极 tDCS 被发现能逆转卒中亚急性期的不良过度连接,促进运动恢复。双半球 tDCS 在卒中早期亚急性期也能加速运动恢复。
区别与差异
TMS 和 tDCS 在调节皮层兴奋性和突触可塑性方面均有效,但二者在机制上存在差异,TMS 能产生更集中的电场,刺激特定神经回路,而 tDCS 则使大量神经元发生弱极化,调节运动激活期间的突触活动。
TMS 和 tDCS 对细胞死亡、氧化应激和胶质细胞的影响
细胞死亡
脑缺血损伤后的线粒体功能障碍和氧化应激可导致凋亡和非凋亡程序化细胞死亡。在缺血性脑卒中,两种主要的凋亡途径可被激活。内源性途径中,促凋亡 Bcl - 2 家族蛋白 Bax 和 Bak 在线粒体外膜形成孔道,释放细胞色素 c 和凋亡诱导因子(AIF)等膜间空间蛋白,激活 caspase(caspase - 3、caspase - 9),导致 DNA 片段化、染色质凝聚和细胞破坏。外源性途径中,细胞外配体(如肿瘤坏死因子(TNF)- α、Fas 配体、TRAIL、糖皮质激素)与细胞膜上的死亡受体结合,激活细胞内 caspase - 8 和 caspase - 3,导致凋亡细胞死亡。研究表明,rTMS 能增加 Bcl - 2 表达,降低 Bax 表达,通过 TUNEL 染色检测凋亡早期和晚期 DNA 断裂发现,rTMS 可下调神经元凋亡。tDCS 治疗也被发现能增加 Bcl - 2/Bax 比值,并降低 caspase - 3 水平。焦亡是一种新发现的炎性程序性细胞死亡形式,由炎性体诱导并由气德敏(GSDM)家族蛋白介导。Luo 等研究表明,θ - 爆发 rTMS(iTBS)能抑制与焦亡相关的蛋白表达,如 caspase - 1、IL - 1β、IL - 18、ASC、GSDMD 和 NLRP1,并抑制 TLR4/NFκB/NLRP3 信号通路,调节小胶质细胞激活,抑制神经元焦亡。铁死亡是一种铁依赖的程序性细胞死亡。在缺血性大脑中,小胶质细胞释放大量金属蛋白酶,破坏细胞外基质,扰乱血脑屏障。GPX4 的失活导致铁死亡细胞死亡,其表达在动物缺血模型中趋于降低。HF - rTMS 能增加 GPX4 水平,降低 ASCL4 和 TFRC 水平,逆转 MCAO 大鼠中 GPX4 水平降低和 ASCL4、TFRC 水平升高,并减少脑脊液中促炎因子浓度,如 IL - 1β、IL - 6 和 TNF - α。
氧化应激
细胞膜脂质降解和线粒体功能障碍导致自由基过度产生,从而损害 DNA 结构、使蛋白质变性和脂质过氧化,导致细胞死亡。NADPH 氧化酶是活性氧的主要来源。脑缺血后,其在神经元和脑血管中的表达迅速增加。阻断 NADPH 激活可保护免受局灶性缺血损伤,减少超氧物生成,改善神经功能。脑缺血后,减少脑损伤的主要机制是通过超氧化物歧化酶(SOD)酶消除O2-,将其转化为 H2O2 和 O2。MnSOD 是最重要的抗氧化细胞成分之一。MnSOD 缺乏会加剧脑梗死,再灌注后脑缺血会降低 MnSOD 表达。因此,增加其浓度及其神经保护效应已成为当前研究的课题研究表明,rTMS 可减少卒中模型中 peri - 基底核皮质区域的 NADPH 氧化酶激活和超氧物产生,并增加 MnSOD 产生,减轻氧化神经元损伤。给予 tDCS 可在脑缺血 / 再灌注(I/R)模型中增加 SOD 水平,特别是在 c/a - tDCS 模式下,即在缺血阶段使用阴极电流,在再灌注期间使用阳极电流。
胶质细胞
TMS 和 tDCS 可影响胶质细胞的形态和激活。在 tDCS 作用下,星形胶质细胞显示出拉长的细胞体,其细胞丝状伪足垂直于直流电场方向。深部脑刺激研究表明,星形胶质细胞的刺激可启动神经胶质递质的释放,触发轴突激活。此外,tDCS 还被证明能以肾上腺素受体依赖的方式增大微胶质细胞体大小。高频重复磁刺激(HFrMS)被证明可直接调节星形胶质细胞,并刺激其分泌体释放神经营养因子,包括 GDNF 和 PDGF - BB,促进缺血后神经元存活。
tDCS 被证明可直接调节星形胶质细胞中的基因表达,上调 BDNF,对神经可塑性、生存和生长至关重要,以及 FOS,在体外分离的星形胶质细胞中标记细胞激活、分化和增殖。此外,DCS 被证明可促进微胶质细胞的吞噬活性,这不仅负责清除碎片,还负责网络重构和吞噬多余的突触,是神经可塑性的标志。
在 MCAO 研究中,rTMS 给药可抑制星形胶质细胞的神经过毒性极化,维持其神经保护表型。tDCS 也被发现对功能恢复有积极影响。在 PT 卒中模型中,给予阴极 - tDCS(c - tDCS)可增强微胶质细胞在病变周围区域的分支,并调节微胶质细胞表型,促使其激活向抗炎反应转变。
TMS 和 tDCS 对神经发生的作用
神经发生涉及神经干细胞的增殖、神经营坯向梗死区的迁移以及向神经元的分化。在成人脑中,神经发生主要发生在侧脑室周围的室下区(SVZ)和海马齿状回的下颗粒区。缺血可触发成人脑中的神经发生,但不足以恢复卒中后的脑功能。在动物卒中模型中,非侵入性脑刺激技术已被证明可促进内源性神经干细胞再生。
联合治疗方法
TMS 和 tDCS 可增强内源性神经干细胞的增殖、迁移、存活和分化,因此越来越多地与干细胞移植联合用于动物模型,以改善外源性干细胞向成熟神经元的分化,并提高其在受损大脑中的整合。目前,联合治疗在卒中患者的临床结果中也显示出改善。一项病例报告显示,在缺血性卒中的急性期后给予间充质干细胞(MSCs)和 rTMS,可改善患者的运动强度和认知功能,通过 NIHSS、Fugl - Meyer 评估和 MoCA - INA 评估。
总 结
非侵入性脑刺激技术(TMS 和 tDCS)在缺血性脑卒中康复中展现出广阔的应用前景。它们通过多种分子机制发挥作用,包括调节细胞死亡、氧化应激和神经发生等过程。未来的研究需要进一步深入探索如治疗参数的个体化、临床试验的设计和结果的可比性等技术的作用机制,优化治疗方案,并结合其他康复策略,以实现更有效的卒中康复治疗。
本文来源:
免责声明:本文内容仅供参考,具体治疗方案请遵循专业医生的建议。
版权声明: 本文仅用于分享,文章版权归原作者所有,未经允许不得转载。



